视网膜色素变性(retinitis pigmentosa,RP)是一类可遗传的视网膜退行性病变(retinal degeneration,RD),以进行性视网膜感光细胞的死亡、视野缺损和视力丧失为特征。目前,全球RP患病率约为1/3000~1/7000。由于RP的遗传学机制复杂,使得该病的具体发病机制尚未完全明确,且缺乏有效的防治措施。一般认为感光细胞的凋亡是RP的共同终末途径,而活性氧(reactive oxygen species,ROS)则被认为是RP发病过程感光细胞凋亡的重要促成因素。氢分子是近年来被发现的一种可选择性清除ROS的抗氧化剂。文献和我们前期的研究发现氢分子可通过抗氧化损伤、调节凋亡、减轻炎症等通路对眼内炎、白内障及视网膜光损伤等眼疾起到保护作用。据此,我们提出研究假说:氢分子对RP视网膜损伤具有保护作用。为了验证研究假说,我们选择N-甲基-N-亚硝基脲(N-Methyl-N-nitrosourea,MNU)诱导RP大鼠模型进行研究。该动物模型具有造模快、可重复性高等优点,是一种常用于RP发病机制和防治措施研究的动物模型。但是,以往的研究仅对该模型的病程时间特征进行研究,而很少涉及该模型视网膜变性的空间特征(如:视网膜变性在中央部与周边部是否存在差异?鼻侧与颞侧是否存在差异?上侧与下侧是否存在差异?外层视网膜变性的同时,内层视网膜是否也发生病变?视网膜不同神经环路的病变是否一致?)。本研究旨在深入研究mnu诱导的rp大鼠视网膜病变时空特点的基础上,验证氢分子对该模型视网膜功能和结构的保护作用,并从抗氧化和抗凋亡角度初步探索其保护机制。本研究将对mnu诱导rp动物模型的发病机制理论进行补充,并为rp的防治提供新思路,同时也为氢分子制剂的临床应用转化提供一定的实验依据。材料与方法实验一:mnu诱导rp大鼠视网膜时空特点评估将90只sd大鼠随机等分5个组:1个对照组和4个mnu干预组。其中各mnu干预组大鼠仅接受1次腹腔注射mnu,剂量为60mg/kg,而对照组腹腔注射等量的生理盐水。四个mnu干预组分别在干预后第一天(p1)、p3、p5、p7天进行各项指标的检测。(1)利用视网膜电图(electroretinogram,erg)从在体水平观察mnu诱导rp大鼠视网膜功能随病程变化的特点;(2)利用多电极阵列(multielectrodearray,mea)从离体水平观察该模型大鼠不同局部(中央/周边、鼻侧/颞侧、上侧/下侧)视网膜的功能;(3)利用光学相干断层扫描(opticalcoherencetomography,oct)从在体水平观察该模型大鼠视网膜结构随病程变化的特点;(4)利用视网膜石蜡切片he染色从离体水平观察该模型大鼠不同局部视网膜的组织结构;(5)利用视网膜铺片免疫荧光染色观察该模型大鼠不同局部视网膜感光细胞的存活情况;(6)利用westernblotting检测该模型大鼠视网膜视杆细胞和视锥细胞的存活情况。(7)利用定量反转录聚合酶链反应(quantitativereversetranscriptionpolymerasechainreaction,qrt-pcr)检测促凋亡基因bax、calpain2、caspase3和抗凋亡基因bcl2的表达情况。
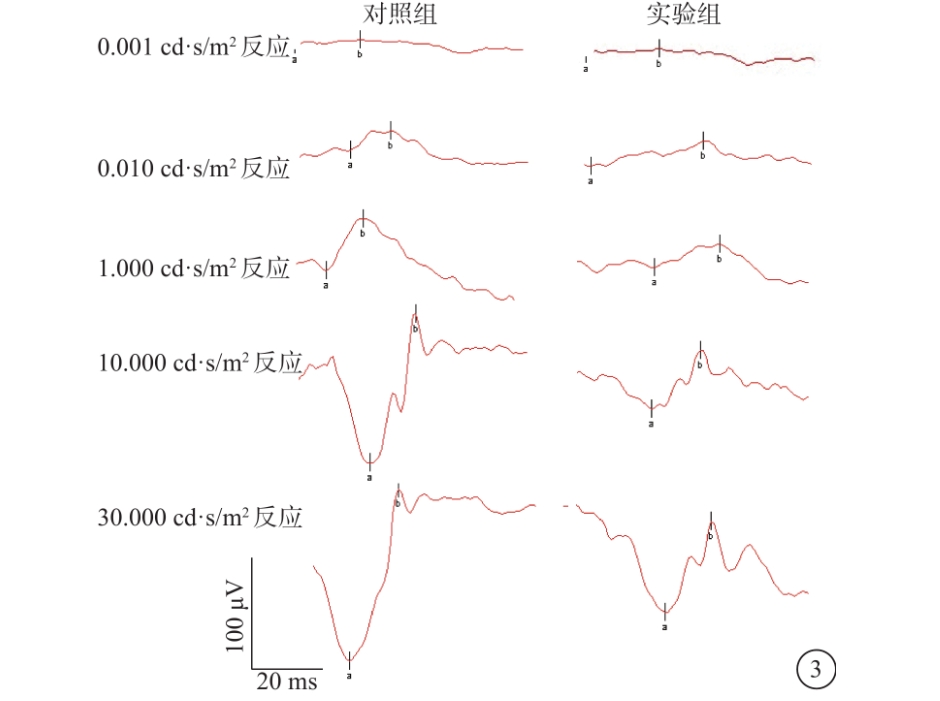
实验二:氢饱和生理盐水对mnu诱导rp大鼠视网膜保护作用的研究将96只sd大鼠随机等分4个组:正常对照组(normalcontrol,nc)、氢饱和生理盐水(hydrogen-richsaline,hrs)对照组、生理盐水干预组(mnu+生理盐水)和hrs干预组(mnu+hrs)。mnu的给药方式及剂量同实验一。hrs和生理盐水的干预方式均为腹腔注射,剂量为10ml/kg/d,于mnu造模前14天开始干预。在mnu造模后第三天(p3)和第七天(p7)天进行各项指标的检测。(1)利用erg和mea场电位从外层视网膜细胞功能角度观察hrs的保护作用;(2)利用mea记录视网膜神经节细胞(retinalganglioncells,rgcs)放电情况,从内层视网膜细胞功能角度观察hrs的保护作用;(3)利用视网膜石蜡切片he染色从形态学角度观察hrs的保护作用;(4)利用视网膜切片tunel染色和qrt-pcr检测凋亡相关基因bax、calpain2、caspase3、bcl2的表达情况,从抗凋亡角度研究hrs保护作用机制;(5)利用羟胺法测定视网膜总超氧化物歧化酶(totalsuperoxidedismutase,t-sod)活性和硫代巴比妥酸法测定视网膜丙二醛(malondialdehyde,mda)含量,从抗氧化角度研究hrs保护作用机制。结果1.大鼠腹腔单次注射60mg/kg的mnu后,视网膜病变表现出以下几个时空特点:(1)mnu干预一周内病变逐渐加重。erg反应及mea场电位反应幅值均逐渐降低,到p7时,几乎都表现为熄灭型反应。oct和he染色测量视网膜外核层(outernuclearlayer,onl)层厚度结果也显示,onl层厚度逐渐变薄,到p7时,onl层细胞基本消失。(2)感光细胞凋亡高峰发生在p3。qrt-pcr检测结果显示,促凋亡基因bax、calpain2和caspase3在p3时表达上调达到峰值,同时抗凋亡基因bcl2的表达也在p3时达到最大程度的下调。(3)病变遵循视杆细胞→视锥细胞的规律。反映视锥细胞功能的明视erg反应幅值下降(p3)要晚于反映视杆细胞功能的暗视erg反应。视网膜铺片感光细胞荧光染色及视杆细胞/视锥细胞特异蛋白westernblotting检测结果也显示,病变早期视杆细胞丢失程度要重于视锥细胞。(4)病变遵循中央部→周边部的规律。mea场电位结果显示,中央部幅值下降最早,随后发展到近周部,最后累及周边部。he染色onl层厚度变薄也表现出这一顺序。(5)病变遵循鼻下→鼻上、颞下→颞上的规律。mea场电位分象限分析结果显示,视网膜鼻下象限幅值最早发生下降,随后是鼻上和颞下,最后发展到颞上象限。视网膜铺片感光细胞荧光染色及qrt-pcr检测视网膜各个象限凋亡水平结果也表现出这一特点。(6)病变遵循on通路→off通路的规律。mea记录rgcs光诱发放电结果显示,on型反应的放电频率明显下降发生在p3,要早于off型反应(p5),病变早期光诱发rgcs总反应下降与on通路病变密切相关。2.hrs对mnu诱导rp大鼠视网膜具有保护作用。在功能学和形态学方面均可见其保护作用:(1)功能学保护作用:hrs干预组较生理盐水干预组而言,其明视erg、暗视erg及mea场电位幅值均明显改善,表明hrs对外层视网膜细胞功能有保护作用。而mea记录rgcs动作电位结果则显示,hrs可有效降低mnu引起的rgcs自发放电频率,提高其对有效视觉信息的反应,表明hrs对内层视网膜细胞功能及视觉通路的完整性也具有保护作用。(2)形态学保护作用:he染色测量视网膜onl层厚度,发现hrs可有效延缓onl层细胞的丢失。3.hrs的这种保护作用无视网膜区域性差异。mea场电位结果及he染色结果均显示,hrs对中央部、近周部和周边部的视网膜功能和结构均有保护作用,无区域性差异。4.hrs对mnu诱导rp大鼠视网膜保护作用与抗氧化相关。hrs干预组较生理盐水干预组而言,视网膜t-sod活性升高,mda含量下降。5.hrs对mnu诱导rp大鼠视网膜保护作用与抗凋亡相关。tunel染色和qrt-pcr结果显示,hrs可以有效降低视网膜组织的凋亡水平,减少视网膜细胞因凋亡而导致的丢失。6.hrs对正常大鼠视网膜结构及功能无不良影响。hrs对照组与正常对照组在各项功能学和形态学检查中,均无统计学差异。
结论1.单次腹腔注射60mg/kg的mnu诱发的rp大鼠视网膜病变存在特定的时间和空间特点。因此,在利用该模型进行rp相关研究时,应选择合适的时间点进行研究,并选择合适的、统一的病变区域进行检测,以达到更加精准的研究目的。2.hrs对mnu诱发rp大鼠的视网膜具有保护作用,可以有效延缓视网膜病变的发展。其保护作用与抗氧化和抗凋亡机制相关。3.HRS对正常视网膜功能及结构无不良影响,对生物体的安全性较高,具备向临床应用转化的潜质。