目的:探究富氢水是否可降低脑缺血再灌注损伤(cerebral ischemia reperfusion injury,CIRI)后大鼠脑组织中死亡相关蛋白激酶1(death-associated protein kinase 1,DAPK1)的表达,并减轻神经细胞自噬性死亡,从而改善神经功能。
方法:将63只大鼠随机分为7个组,假手术组(Sham)为1个组,模型组(CIR)组分为再灌注12h、24h、48h时间点3个亚组,富氢水(CIR+HW)组分为再灌注12h、24h、48h时间点3个亚组,每组9只。Sham组大鼠仅进行血管分离,术后立即生理盐水5ml/kg腹腔注射;CIR组大鼠插入线栓建立大脑中动脉栓塞(middle cerebral artery embolization,MCAO)模型,缺血1.5h后拔出线栓进行再灌注,术后立即生理盐水5ml/kg腹腔注射;CIR+HW组大鼠同样建立MCAO模型,缺血1.5h后拔出进行再灌注,术后立即富氢水5ml/kg腹腔注射。观察各组大鼠行为学变化,并在相应时间点进行改良神经损伤严重程度(modified neurological severity score,m NSS)评分,之后于相应时间点麻醉后处死大鼠并收集脑组织标本。各组大鼠随机选择3只,取完整大脑组织进行2,3,5-三苯基氯化四氮唑(2,3,5-triphenylt-etrazolium chloride,TTC)染色检测梗死体积;剩余各组大鼠取材后在扫描电镜下观察脑组织的细胞形态、透射电镜下观察神经细胞的超微结构、实时荧光定量聚合酶链反应(real-time quantitative polymerase chain reaction,RT-q PCR)检测DAPK1、Beclin1、空泡分选蛋白34(vacuolar protein sorting 34,VPS34)、微管相关蛋白轻链3-B(microtubule-associated protein light chain 3-B,LC3-B)m RNA的表达和蛋白质印迹法(western blot,WB)检测DAPK1、Beclin1、VPS34、LC3-B蛋白的表达。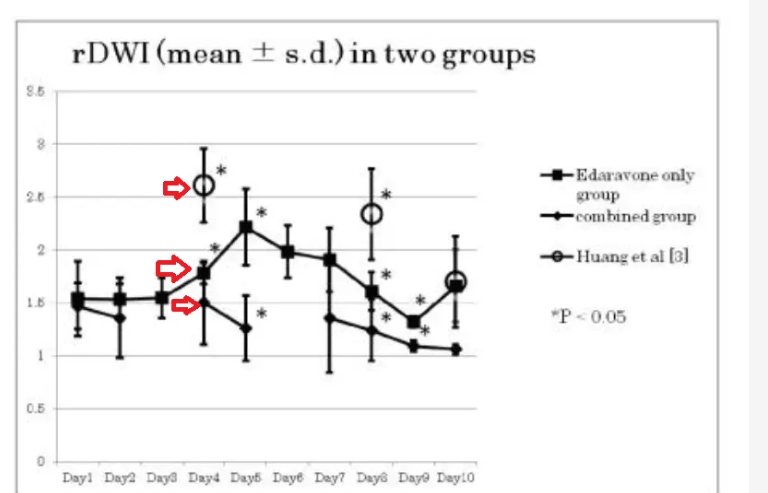
结果:与Sham组比,各时间点CIR组和CIR+HW组大鼠的m NSS评分显著增高;与CIR组比,48h时间点CIR+HW组大鼠的mNSS评分较CIR组显著降低(P<0.05)。与Sham组比,各时间点CIR组和CIR+HW组大鼠脑组织TTC染色可见明显梗死灶;与CIR组比,各时间点CIR+HW组大鼠的脑梗死体积均显著减少(P<0.05)。Sham组大鼠脑组织扫描电镜下可见细胞形态结构正常;各时间点CIR组大鼠脑组织明显水肿,大量神经细胞核周围空泡改变,部分细胞核变形、碎裂,结构疏松,胞浆淡染,微血管皱缩或破坏,淋巴细胞浸润;各时间点CIR+HW组与CIR组大鼠扫描电镜下比较,脑组织水肿稍减轻,神经细胞核周围空泡减少,核变形和破裂少见,结构稍紧密,胞浆淡染,微血管皱缩破坏减少,淋巴细胞浸润减少。Sham组大鼠脑组织超微结构见神经细胞形态结构正常;12h时间点CIR组大鼠脑组织超微结构见神经细胞水肿,细胞膜部分缺失,细胞器分布杂乱,线粒体多数肿胀、脊断裂,粗面内质网扩张,胞内见自噬小体和自噬溶酶体,胞核呈椭圆形,核膜部分断裂,核仁边移;12h时间点CIR+HW组与12h时间点CIR组大鼠脑组织超微结构比较,同样可见神经细胞水肿,细胞膜缺失,细胞器杂乱分布,但线粒体肿胀和脊断裂减少,粗面内质网扩张减轻,自噬体形成减少,胞核呈椭圆形,核膜完整,核仁稍有边移。与Sham组比,各时间点CIR组和CIR+HW组大鼠脑组织中的DAPK1、Beclin1、VPS34、LC3-B m RNA的表达量均显著增加(P<0.05);与CIR组比,各时间点CIR+HW组大鼠脑组织中的DAPK1、Beclin1、VPS34、LC3-B m RNA的表达量显著降低(P<0.05)。与Sham组比,各时间点CIR组和CIR+HW组大鼠脑组织中的DAPK1、Beclin1、VPS34及LC3-B蛋白表达量显著增加(P<0.05);与CIR组比,各时间点CIR+HW组大鼠脑组织中的DAPK1、Beclin1、VPS34和LC3-B蛋白表达量显著降低(P<0.05)。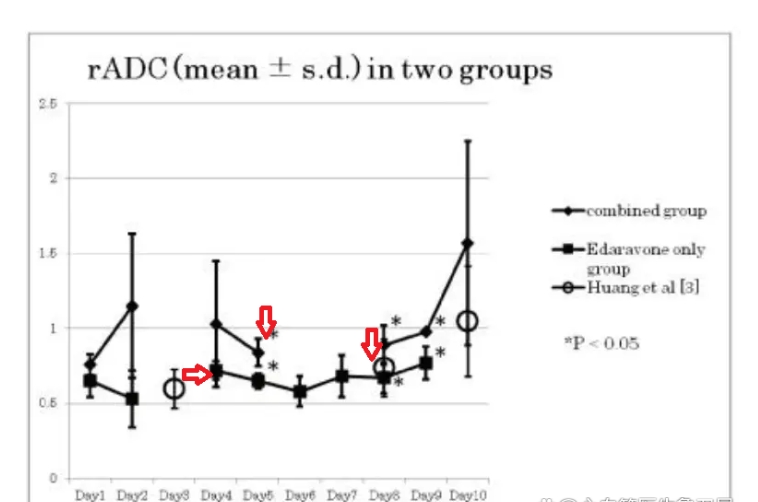
结论:富氢水可以降低CIRI大鼠脑组织中DAPK1的表达,由此下调其下游自噬相关因子的表达,减少自噬体的形成,减轻神经细胞自噬性死亡,从而改善神经功能。
10.27045/d.cnki.ggyyc.2022.000188